| |
|
|
 Qualitätsmanagement, Regulatory Affairs & Kommunikation, Stress-Management und Auditpsychologie
Qualitätsmanagement, Regulatory Affairs & Kommunikation, Stress-Management und Auditpsychologie
Überblick meiner Qualifikationen: Medizintechnik / Pharma Projekt Management (Europa, USA, Japan), Qualitätsmanagement, GMP Guidelines und Gesetze z.B.: AMWHV, EU-GMP Leitfäden I, II, IV (ATMP) & Annexe, ICH Guidelines und FDA/USA 21 CFR 4, 11, 210/211, 820; MEDDEV / MDCG, MPG / MPDG, MDD, 93/42/EWG, MDR/IVDR 2017/745-746; MDSAP; Gebrauchstauglichkeit (Usability / Human Factors and Usability Engineering gemäß IEC 62366 / FDA CDRH); DIN EN ISO 13485:2012/2016; Audits / Inspektionen z.B. durch die FDA; Regulatory Affairs, z.B.: Medical Devices (510(k), ehem. STED Format), Pharma CMC Part – Modul 3, Combination Products / Companion Products, Phyto-Pharmazeutika, z.B., Zulassung in Deutschland, Europa, USA, Japan, Korea, Canada, Australien, Brasilien; Arbeits- und Organisationspsychologie, Kommunikation, Stress-Management Schulungen, Auditpsychologie und Audit Schulung für Mitarbeiter / Auditoren, firmeninterne Schulungen & Dozentin für Qualitätsmanagement.
Bitte klicken Sie auf die folgenden Themen, um mehr Information zu erhalten:
Beratung, Projektmanagement und aktive Unterstützung (hands-on), z.B. Erstellung und Review von Dokumenten, wie QMHs, PQRs / APRs gemäß EU-GMP Leitfaden Teil I - 1.10 (drugs) oder Teil II - 2.6 (APIs) und ICH Q7 / 21 CFR 211, SOPs oder Formblättern, Durchführung von GxP Audits, Gap-Analysen, mit dem Ziel der "optimalen Konformität" mit gesetzlichen Vorgaben (z.B. EU / US GMP; GDP Leitlinie 2013/C 343/01), EU-Direktiven und ISO Standards (z.B. 9000ff, 17025, 13485), die einen Mehrwert für die Qualitäts- und Produktionsprozesse bringt --- Qualitätsmanagement auf der Basis wissenschaftlich-fundierter, risikobasierter Bewertungen, das sich pragmatisch und anwendbar in das bestehende System (z.B. Personen, interessierte Parteien / Stakeholder, Firmenkultur) einfügt, sowie das Kosten-Nutzen Verhältnis berücksichtigt.
Neben den nationalen deutschen Vorgaben des AMG / AMWHV / MPDG / (MPG), werden z.B. die Gesetze der US cGMP (z.B. 21 CFR Parts 210, 211, 820 QSR und 11, 4 [Final Guidance]), die ICH Quality Guidelines (z.B. Q7, Q9(R1) [2023], Q10), die harmonisierten ISO Normen und die MDD / MDR bzw. IVDR, sowie die Qualitätselemente gemäß den 9 Kapiteln des EU-GMP Leitfadens Teil I, sowie Annexe 1 - 21 und falls anwendbar Teil IV (ATMP) berücksichtigt:
Kapitel 1: Pharmazeutisches Qualitätssystem (Pharmaceutical Quality System)
Kapitel 2: Personal (Personnel)
Kapitel 3: Räumlichkeiten und Ausrüstung (Premise and Equipment)
Kapitel 4: Dokumentation (Documentation)
Kapitel 5: Produktion (Production)
Kapitel 6: Qualitätskontrolle (Quality Control)
Kapitel 7: Ausgelagerte Tätigkeiten (on Outsourced activities)
Kapitel 8: Beanstandungen, Qualitätsmängel und Produktrückrufe (Complaints and Product Recall)
Kapitel 9: Selbstinspektion (Self-Inspection)
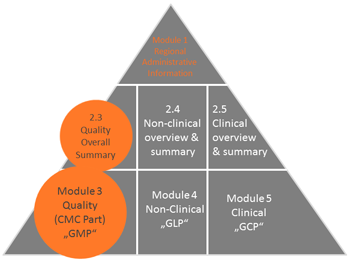
Wissenschaftlich fundierte und strukturierte Erstellung von technischer Dokumentation, z.B. im ehemaligen STED Format ("nlVDMAToC" oder "IVDMAToC", März 2019) und Zulassungsdokumenten der Module 3 und 2.3 der "Common Technical Documents (CTD)", die bei Behörden akzeptiert werden, z.B. „Drug Master Files, DMFs“, „Active Substance Master Files, ASMFs“, “Certificates of Suitability, CEPs“, „Investigational Medicinal Product Dossiers, IMPDs“, „Investigational New Drugs, INDs“ für nationale und internationale Zulassung (z.B. EU, USA, Kanada, Japan), sowie Erstellung und Bearbeitung von eCTD gemäß ICH M2, M8 mit marktüblicher Software.
Nach dem Mutual Recognition Agreement (MRA) wird sich vermutlich die Zahl der FDA Routine-Inspektionen in Europa zukünftig verringern. Auch in Deutschland, nach der Anerkennung der "Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten (ZLG)" am 26.06.2019 wird es voraussichtlich weniger FDA Inspektionen geben. Die FDA wird aber weiterhin "product manufacturing assessment inspections" auch in anerkannten Ländern durchführen, um Marktzugangsentscheidungen zu treffen.
Man hört und liest vieles über die Schrecken von FDA Inspektionen und erhält auch ebensoviele Tipps zu Strategien damit umzugehen. Aber, es gibt nicht die FDA Inspektion!
FDA Inspektionen werden neben den harten Fakten, wie belegbaren schriftlichen Nachweisen der Qualität (written evidence), zu einem großen Teil von den individuellen Persönlichkeitseigenschaften der Inspektoren und Auditierten beeinflusst, der Auditpsychologie. Aus diesem Grund ist es notwendig für jede inspizierte Firma einen individuellen Ansatz zu erarbeiten, damit die Inspektion ein Erfolg wird, d.h. keine FDA Form 483 Beobachtung erzielt wird. Deshalb habe ich in den vergangen Jahren die komplexe Psychologie der gesamten Inspektionsphase von der Ankündigung bis zum Abschluss der möglichen Nacharbeiten bei verschiedenen inspizierten Firmen erforscht, um Maßnahmen optimal anwenden zu können. Typische Schritte zur Vorbereitung und Begleitung von FDA Audits im Bereich Pharma- und Medizintechnik sind:
- Erfahrungsbasierte Vorbreitung und Optimierung der Firmenpräsentation sowie der Inspektionsumgebung, z.B. Unterbringung und Abholung des/der Inspektor(en), Catering, Raumplanung, Firmenvorstellung, Besetzung Front / Back Office und Kommunikation während der Inspektion
- Schulung der mitwirkenden Personen, z.B. Audit-Psychologie, Stress-Management vor / im Audit, zielführende Präsentation des QM-Systems im Audit
- Prüfung und Optimierung der 5 Kernprozesse: CAPA, Change Control, Deviations, OOS, Training
 "CAPA --- it's magic" Zitat einer FDA Inspektorin, Mai 2015
"CAPA --- it's magic" Zitat einer FDA Inspektorin, Mai 2015 - Prüfung und Erstellung von Dokumenten, z.B. Qualitätsmanagement Handbuch (Quality Manual), Verantwortungsabgrenzungsverträge (Technical / Quality Agreements) gemäß § 9 AMWHV, EU-GMP Leitfaden Kapitel 7
- Vorbereitung von Audits gemäß Medical Device Single Audit Program (MDSAP) der FDA
Weitere Informationen:
- Co-Autorin des Buchkapitels 'Tipps für eine gelungene FDA-Inspektion' in Der HPLC Experte [ISBN 978-3-527-33306-6, Wiley-VCH, Weinheim, Hrsg. Stavros Kromidas, 2014]
- Durchsuchbare, aktuelle Liste der Warning Letters auf den Internetseiten der FDA.
Mitarbeiter oder "Human Resources" sind das Kapital einer Firma. Deshalb sind die Mitarbeiterzufriedenheit und die Passung neuer Mitarbeiter bei der internen Positionierung oder Einstellung sehr wichtig für die Optimierung oder Weiterentwicklung einer Firma, insbesondere bei kleinen und mittelständischen Unternehmen. In diesem Zusammenhang biete ich folgende Dienstleistungen an:
- Durchführung von strukturierten Arbeitsplatz- und Anforderungsanalysen, gemäß den Standards der Arbeits-und Organisationspsychologie
- Durchführung von Potentialanalysen für die interne Positionierung sowie Mitarbeitersuche und Bewerberauswahl mit strukturierten Interviews (in Anlehnung an das Multimodale Interview MMI, nach Heinz Schuler, 1992), unter Einhaltung der Normen DIN 33430 "Anforderungen an Verfahren und deren Einsatz bei berufsbezogenen Eignungsbeurteilungen" und ISO 10667 "Assessment service delivery — Procedures and methods to assess people in work and organizational settings"
Durchführung von Schulungen für Einzelpersonen oder Gruppen in der regulierten Industrie. Eine typische Schulung umfasst folgende Themen, die individuell angepasst, d.h. ergänzt oder gekürzt werden können:
- Analyse des Arbeitsumfeldes, z.B. Analyse des QM-Systems anhand von Dokumenten, SOPs vor dem Workshop sowie anhand von "subjektiven" Informationen aus dem persönlichen Gespräch vor der Schulung
- Betrachtung der Stress-Bestandteile (empfundene Stressoren) und Kompetenzen; die 3 Stressbestandteile und die 3 Säulen des Stressmanagement, nach Prof. Dr. Gert
Kaluza:
(1) Regeneratives Stressmanagement (erholen, aber richtig),
(2) Mentales Stressmanagement (stressverstärkende Denkmuster entdecken)
(3) Instrumentelles Stressmanagement (Arbeitsumfeld optimieren) - Umgang mit Konflikten in der Organisation / in der Abteilung, Analyse der Kommunikation
- Die Wahrnehmung von Selbstbild vs.Fremdbild ("Johari Fenster")
- Analyse der Motivationen der "Arbeitsdomaine"; Strategien und Motivationstechniken
für den Umgang mit beruflichen Anforderungen; Die Erlebnisse in den verschiedenen
"Domainen" beeinflussen sich mittels "Stress Spillover", d.h. der Übertragung von
Stress zwischen verschiedenen Domainen, wie Beruf und Privatleben (intra-individuell). - Erlernen von Techniken, die eine besser empfundene Work – Life – Balance
ermöglichen.
Es liegen die notwendigen Qualifikationen vor, die eine Zuzahlung / Kostenübernahme der Krankenkasse nach § 20 SGB V ermöglichen.
Um Systeme und Prozesse optimieren und weiter entwickeln zu können, braucht man "auswertbare" Informationen von Experten dieser Systeme und Prozesse. Labor-, Pausen- und Ganggespräche oder individuelle Meinungen einzelner, besonders kommunikativer Mitarbeiter bzw. Kunden sind dabei nicht als "auswertbare" Information zu bewerten.
Mit Hilfe anonymer Mitarbeiter- oder Kundenumfragen werden in standardisierter und statistisch auswertbarer Form (online und/oder Papier), firmenspezifisch erarbeitete Fragen zu den typischen Abläufen beantwortet, sowie explorative Freitextfelder angeboten, die repräsentative Hinweise auf bisher unbekannte Meinungstrends geben können. Eine Umfrage umfasst folgende Schritte:
- Projekt- und Zieldefinition
- Erarbeitung eines erfahrungsbasierten Konzepts, Abstimmung mit dem Auftraggeber
- Durchführung der Umfrage, statistische Auswertung der Umfrage
- Erstellung eines Ergebnis-Berichts
- Feedback der Ergebnisse, Präsentation der Ergebnisse vor Ort
- Diskussion von Maßnahmen zur Optimierung und Weiterentwicklung
- Evaluation der Erreichung der Projekt- und Zieldefinition
Zu den oben genannten Themengebieten biete ich Schulungen und Seminare "in-House" an, z.B.:
- "QM-Auditor(in)"
 : 1-tägige Schulung und Ausbildung von internen / externen Auditoren.
: 1-tägige Schulung und Ausbildung von internen / externen Auditoren. - "Qualitätsmanagement Basics"
 : 1-tägige Schulung zur Vermittlung des grundelegenden Wissens über Qualitätsmanagement und Qualitätsmanagement-Werkzeuge.
: 1-tägige Schulung zur Vermittlung des grundelegenden Wissens über Qualitätsmanagement und Qualitätsmanagement-Werkzeuge. - Stress Management (siehe oben): 1-tägige Schulung zur Analyse der eigenen "Stressoren" und dem Erlernen eines geeigneten Umgangs mit empfundenem Stress.
Für weitere Informationen oder zur Terminvereinbarung kontaktieren Sie mich bitte.
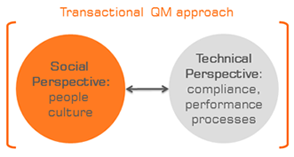
Abbildung: Bei meinen Projekten wende ich einen umfassenden, "transaktionalen" Qualitätsmanagement-Ansatz an,
der die sozio-kulturelle Perspektive ebenso wie die technische Perspektive einbezieht.